
Cu + O2 → CuO | Cu ra CuO
Phản ứng: Cu + O2 → CuO
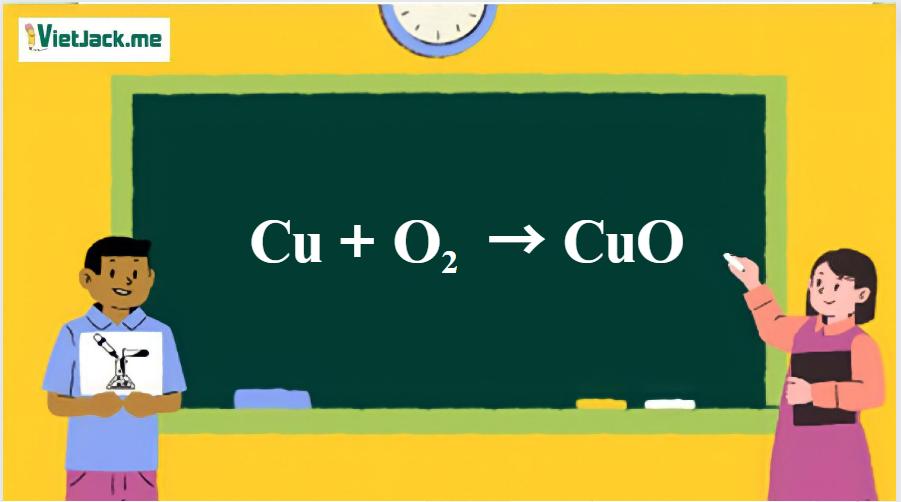
1. Phương trình hóa học phản ứng giữa Cu và O2
2Cu + O2 → 2CuO
2. Điều kiện phản ứng
- Nhiệt độ cao.
3. Cách thực hiện phản ứng
- Đốt cháy dây đồng trong không khí rồi cho vào bình khí oxi.
4. Hiện tượng nhận biết phản ứng
- Cu cháy trong bình khí oxi tạo thành chất rắn màu đen.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của Cu
Là chất kim loại đóng vai trò là chất khử (chất nhận electron) trong phản ứng này.
5.2 Bản chất của O2
- Trong phản ứng này, O2 là chất khí oxi đóng vai trò là chất oxi hóa (chất cho electron)
6. Tính chất hóa học của Cu
- Là kim loại kém hoạt động, có tính khử yếu.
6.1 Tác dụng với phi kim:
- Cu phản ứng với oxi khi đun nóng tạo CuO bảo vệ nên Cu không bị oxi hoá tiếp tục.
- Khi tiếp tục đun nóng tới (800-1000oC)
- Tác dụng với Cl2, Br2, S...
6.2 Tác dụng với axit:
- Cu không tác dụng với dung dịch HCl, H2SO4 loãng.
- Khi có mặt oxi, Cu tác dụng với dung dịch HCl, nơi tiếp xúc giữa dung dịch axit với không khí.
2Cu + 4HCl + O2 → 2CuCl2 + 2 H2O
- Với HNO3, H2SO4 đặc :
Cu + 2H2SO4 đ → CuSO4 + SO2 + H2O
Cu + 4HNO3 đ → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
6.3 Tác dụng với dung dịch muối:
- Khử được ion kim loại đứng sau nó trong dung dịch muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
7. Tính chất hóa học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
7.1 Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
7.2 Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
7.3 Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
8. Bạn có biết
- Các kim loại cháy trong bình khí oxi như (Na, Al, Fe, …. ) tạo thành oxit kim loại.
9. Ví dụ minh họa
Ví dụ 1: Oxi hóa hoàn toàn m (g) hỗn hợp X gồm Cu và Al có tỉ lệ mol là 1:1 thu được 13,1g hỗn hợp Y gồm các oxit. Giá trị của m là
A. 7,4. B. 8,7.
C. 9,1. D. 10.
Đáp án C
Hướng dẫn giải:
Gọi số mol của Cu và Al là a (mol)
Bảo toàn nguyên tố Cu và Al ta có
nCu = nCuO = amol
nAl = 2 nAl2O3 ⇒ nAl2O3 = a/2 mol
⇒ mY = mCuO + mAl2O3 = 80a + 102.a/2 = 13.1g
⇒ a = 0,1 mol
⇒ mX = 0,1.(64 + 27) = 9,1g
Ví dụ 2: Oxi hóa hoàn toàn 6,4g Cu thu được 8g đồng oxit. Khối lượng của oxi cần dùng là:
A. 3,2g B. 1,6 g
C. 0,8g D. 4,8g
Đáp án B
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng ta có
mCu + mO2 = mCuO ⇒ mO2 = mCuO - mCu = 8 - 6,4 = 1,6g
Ví dụ 3: Thể tích khi oxi cần dùng để oxi hóa hoàn toàn 3,2 g Cu là
A. 2,24 (l) B. 1,12 (l)
C. 0,56 (l) D. 3,36 (l)
Đáp án C
Hướng dẫn giải:
nCu = 0.05 mol
Theo phương trình hóa học:
Cu + 1/2O2 → CuO
0,05 → 0,025 mol
⇒ nO2 = 0,025. 22,4 = 0,56 (l).
Link nội dung: https://wikigerman.edu.vn/cu-ra-cuo-a45472.html